Dr Iva Talaber
Stimulation du cycle capillaire naturel avec le laser Er:YAG fractionné non ablatif
L’alopécie androgénétique est un processus de chute de cheveux qui provoque un dégarnissement fréquent chez les hommes. Cela entraine un effet négatif sur l’image de soi. Avec les nombreux et différents traitements pharmacologiques, chirurgicaux, à base de lumière ou nutraceutiques disponibles, sélectionner la thérapie la plus appropriée peut s’avérer difficile.
L’alopécie androgénétique (AAG) ou calvitie masculine est un trouble multifactoriel causé par des facteurs génétiques, une dérégulation hormonale, des facteurs environnementaux et systémiques et le vieillissement 1. On estime que l’AAG touche 50 % des hommes et des femmes de type caucasien âgés de 50 à 80 ans 2. La prévalence et la gravité de l’AAG au sein des ethnies asiatiques et africaines sont inférieures à celles des Caucasiens 3,4. L’incidence de l’AAG augmente avec l’âge chez les deux sexes et dans toutes les ethnies 5. Les cheveux étant un élément important pour son identité et l’image de soi, les patients atteints d’alopécie androgénétique peuvent souffrir d’une dévalorisation de soi entrainant une diminution de leur qualité de vie 6,7, voire une cause possible de dépression chez les jeunes adultes. 8
Les traitements disponibles comprennent des produits pharmaceutiques oraux et topiques, des nutraceutiques, le laser, le plasma riche en plaquettes (PRP) et des procédures de transplantation chirurgicale 9. Les produits pharmaceutiques approuvés par la FDA sont le Finastéride oral et le Minoxidil topique mais de nombreux patients recherchent des alternatives à ces traitements qui peuvent entrainer des effets secondaires indésirables. 8
L’AAG se caractérise par une diminution graduelle et progressive des follicules pileux, accompagnée d’une baisse du rapport entre la croissance active et les étapes de repos du cycle pilaire. 8 Les follicules pileux sont riches en cellules souches, qui se régénèrent selon des cycles continus composés de trois étapes : Phase anagène ou phase de croissance du cheveu, phase catagène ou phase de repos du cheveu, phase télogène ou phase d’expulsion du cheveu, qui sont toutes largement affectées par la voie de signalisation Wnt/β-caténine. 10, 11. La papille dermique du follicule pileux est un régulateur majeur du cycle pilaire, notamment de l’activation des cellules progénitrices. 10 Il est intéressant de noter que la régulation positive des voies de signalisation Wnt/β-caténine a été indiquée dans plusieurs options de traitement par AAG, avec une efficacité démontrée, notamment le minoxidil 12, le PRP 13,14 et le traitement au laser. 15
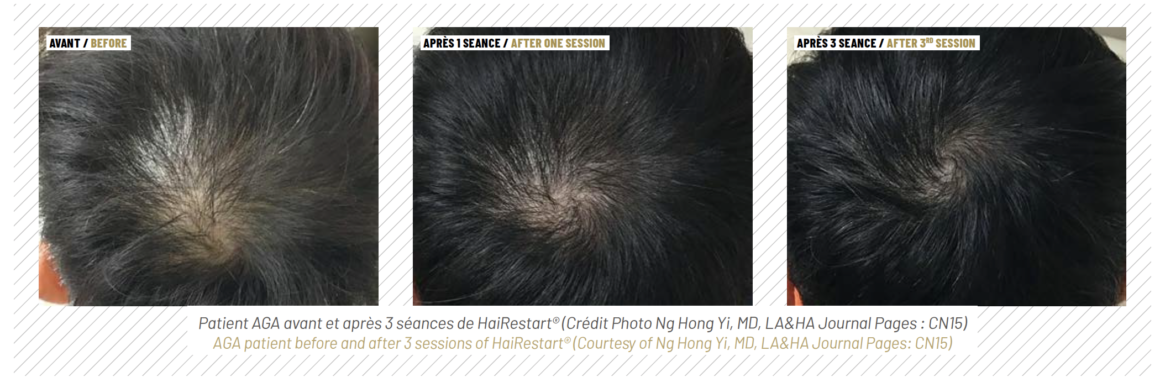
De nombreuses études ont démontré l’efficacité de la thérapie au laser pour l’AAG 2,10,16 et l’absence d’effets indésirables 17,18. Alors que la thérapie laser de faible intensité utilise des mécanismes de photobiomodulation pour induire le métabolisme cellulaire 19, les lasers médicaux à haute énergie induisent la régénération des tissus grâce à des effets photothermiques 9,10. Le traitement de repousse des cheveux au laser est associé à un risque minime et à des résultats potentiellement meilleurs par rapport au traitement pharmacologique standard 2,9. Des études sur des modèles murins suggèrent que l’irradiation laser affecte le cycle pilaire en favorisant les transitions télogène-anagène 20 dans les traitements non ablatifs (verre d’erbium à 1 550 nm 20) et ablatifs (erbium-YAG à 2 940 nm et laser CO2 à 10 600 nm 21). De plus, l’énergie laser agit en augmentant le flux sanguin au niveau de la papille dermique 22.
Les lasers ablatifs et non ablatifs ont déjà été utilisés avec succès en monothérapie pour traiter l’alopécie androgénétique chez les hommes et les femmes (1540 nm Er:glass 23, 1550 nm Er:glass 20,24,25, 2940 nm Er:YAG 26-28, 1927 nm thulium 29 et laser CO221 10 600 nm). Ces dernières années, la combinaison de la thérapie au laser avec d’autres traitements, telles que les produits pharmaceutiques 30-33, les exosomes et le PRP29, est en hausse.
La thérapie laser HAIRestart® de Fotona s’appuie sur la longueur d’onde Er:YAG de 2 940 nm pour effectuer une procédure non ablative à l’aide d’un mode SMOOTH™ breveté, composé de trains d’impulsions laser sous-ablatives. L’avantage du laser Er:YAG utilisé en mode SMOOTH™ est que la lumière laser est absorbée dans la couche la plus superficielle (<10 μm) de la peau, la chaleur se diffusant uniquement vers les couches plus profondes, ce qui en fait une forme d’énergie très sûre, particulièrement important lors du traitement du cuir chevelu. Les impulsions de chaleur pénètrent dans la peau jusqu’à environ 0,5 mm de profondeur, entraînant une hyperthermie tissulaire ainsi qu’une signalisation paracrine qui active les fibroblastes pour initier des processus de régénération dans la peau 34,35. Les effets de la thérapie HAIRestart® sur le cuir chevelu comprennent une amélioration de l’apport sanguin aux follicules pileux 22, une stimulation du cycle capillaire en favorisant des transitions télogènes-anagènes plus rapides 20, une augmentation de la densité et de l’épaisseur des cheveux36 et la prévention d’une nouvelle chute de cheveux 26.
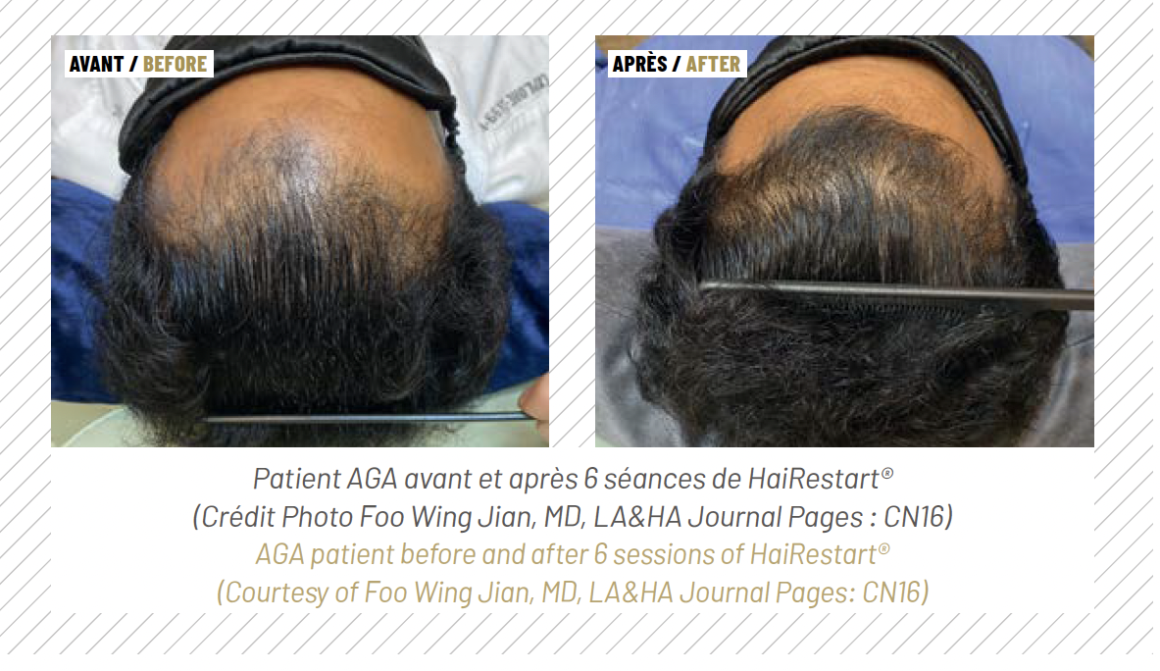
HAIRestart® est une bonne alternative aux produits pharmaceutiques sous forme de monothérapie, et un traitement de complément à d’autres procédures, pour stabiliser la chute des cheveux avant une greffe de cheveux, ou en entretien. Cette polyvalence unique lui permet de combler plusieurs niches dans la thérapie AAG. N
Références / References
1. Cuevas-Diaz Duran, R. et al. The Biology and Genomics of Human Hair Follicles: A Focus on Androgenetic Alopecia. Int. J. Mol. Sci. 25, (2024).
2. Afifi, L. et al. Low-level laser therapy as a treatment for androgenetic alopecia. Lasers Surg. Med. 49, 27–39 (2017).
3. Tanaka, Y., Aso, T., Ono, J., Hosoi, R. & Kaneko, T. Androgenetic Alopecia Treatment in Asian Men. J. Clin. Aesthet. Dermatol. 11, 32–35 (2018).
4. Wang, T. L. et al. Prevalence of androgenetic alopecia in China: a community-based study in six cities. Br. J. Dermatol. 162, 843–847 (2010).
5. Fan, S. M. Y., Cheng, Y. P., Lee, M. Y., Lin, S. J. & Chiu, H. Y. Efficacy and safety of a low-level light therapy for androgenetic alopecia: A 24-week, randomized, double-blind, self-comparison, sham device-controlled trial. Dermatologic Surg. 44, 1411–1420 (2018).
6. Han, S.-H. et al. Quality of life assessment in male patients with androgenetic alopecia: result of a prospective, multicenter study. Ann. Dermatol. 24, 311–318 (2012).
7. Cash, T. F. The psychological effects of androgenetic alopecia in men. J. Am. Acad. Dermatol. 26, 926–931 (1992).
8. Sonthalia, S. Hair Restoration in Androgenetic Alopecia: Looking Beyond Minoxidil, Finasteride and Hair Transplantation. J. Cosmetol. Trichology 02, (2016).
9. Dabek, R. J., Austen, W. G. & Bojovic, B. Laser-assisted Hair Regrowth: Fractional Laser Modalities for the Treatment of Androgenic Alopecia. Plast. Reconstr. surgery. Glob. open 7, e2157 (2019).
10. Perper, M., Aldahan, A. S., Fayne, R. A., Emerson, C. P. & Nouri, K. Efficacy of fractional lasers in treating alopecia: a literature review. Lasers Med. Sci. 32, 1919–1925 (2017).
11. Kitagawa, T. et al. Keratinocyte growth inhibition through the modification of Wnt signaling by androgen in balding dermal papilla cells. J. Clin. Endocrinol. Metab. 94, 1288–1294 (2009).
12. Kwack, M. H., Kang, B. M., Kim, M. K., Kim, J. C. & Sung, Y. K. Minoxidil activates β-catenin pathway in human dermal papilla cells: a possible explanation for its anagen prolongation effect. J. Dermatol. Sci. 62, 154–159 (2011).
13. Gentile, P. & Garcovich, S. Systematic review of platelet-rich plasma use in androgenetic alopecia compared with minoxidil®, finasteride®, and adult stem cell-based therapy. Int. J. Mol. Sci. 21, 1–26 (2020).
14. Zheng, Z. et al. Up-regulation of fibroblast growth factor (FGF) 9 expression and FGF-WNT/β-catenin signaling in laser-induced wound healing. Wound Repair Regen. 22, 660–665 (2014).
15. Ke, J. et al. Erbium: YAG laser (2,940 nm) treatment stimulates hair growth through upregulating Wnt 10b and β-catenin expression in C57BL/6 mice. Int. J. Clin. Exp. Med. 8, 20883–20889 (2015).
16. Zarei, M., Wikramanayake, T. C., Falto-Aizpurua, L., Schachner, L. A. & Jimenez, J. J. Low level laser therapy and hair regrowth: an evidence-based review. Lasers in Medical Science vol. 31 363–371 (2016).
17. Katzer, T., Leite Junior, A., Beck, R. & da Silva, C. Physiopathology and current treatments of androgenetic alopecia: Going beyond androgens and anti-androgens. Dermatol. Ther. 32, e13059 (2019).
18. Liu, K.-H., Liu, D., Chen, Y.-T. & Chin, S.-Y. Comparative effectiveness of low-level laser therapy for adult androgenic alopecia: a system review and meta-analysis of randomized controlled trials. Lasers Med. Sci. (2019) doi:10.1007/s10103-019-02723-6.
19. Avci, P., Gupta, G. K., Clark, J., Wikonkal, N. & Hamblin, M. R. Low-level laser (light) therapy (LLLT) for treatment of hair loss. Lasers Surg. Med. 46, 144–151 (2014).
20. Kim, W.-S. et al. Fractional photothermolysis laser treatment of male pattern hair loss. Dermatologic Surg. Off. Publ. Am. Soc. Dermatologic Surg. [et al.] 37, 41–51 (2011).
21. Bae, J. M., Jung, H. M., Goo, B. & Park, Y. M. Hair regrowth through wound healing process after ablative fractional laser treatment in a murine model. Lasers Surg. Med. 47, 433–440 (2015).
22. Avram, M. R., Leonard, R. T., Epstein, E. S., Williams, J. L. & Bauman, A. J. The current role of laser/light sources in the treatment of male and female pattern hair loss. Journal of Cosmetic and Laser Therapy vol. 9 27–28 (2007).
23. Alhattab, M. K., AL Abdullah, M. J., Al-janabi, M. H., Aljanaby, W. A. & Alwakeel, H. A. The effect of 1540-nm fractional erbium-glass laser in the treatment of androgenic alopecia. J. Cosmet. Dermatol. 19, 878–883 (2020).
24. Lee, G. Y., Lee, S. J. & Kim, W. S. The effect of a 1550 nm fractional erbium-glass laser in female pattern hair loss. J. Eur. Acad. Dermatology Venereol. 25, 1450–1454 (2011).
25. Meephansan, J., Ungpraphakorn, N., Ponnikorn, S., Suchonwanit, P. & Poovorawan, Y. Efficacy of 1,550-nm erbium-glass fractional laser treatment and its effect on the expression of insulin-like growth factor 1 and Wnt/b-catenin in androgenetic alopecia. Dermatologic Surg. 44, 1295–1303 (2018).
26. Day, D., Mccarthy, M. & Talaber, I. Non-ablative Er:YAG laser is an effective tool in the treatment arsenal of androgenetic alopecia. J. Cosmet. Dermatol. 00, 1–8 (2021).
27. Dai, R., Yang, X., Su, Y. & Wu, X. Effectiveness and safety of the ablative fractional 2940-nm Er: YAG laser for the treatment of androgenetic alopecia. Lasers Med. Sci. 39, 128 (2024).
28. Su, Y.-P. & Wu, X.-J. Ablative 2940 nm Er: YAG fractional laser for male androgenetic alopecia. Dermatologic therapy vol. 35 e15801 (2022).
29. Cho, S. Bin et al. Therapeutic efficacy and safety of a 1927-nm fractionated thulium laser on pattern hair loss: an evaluator-blinded, split-scalp study. Lasers Med. Sci. 33, 851–859 (2018).
30. Esmat, S. M. et al. Low level light-minoxidil 5% combination versus either therapeutic modality alone in management of female patterned hair loss: A randomized controlled study. Lasers Surg. Med. 49, 835–843 (2017).
31. Suchonwanit, P., Rojhirunsakool, S. & Khunkhet, S. A randomized, investigator-blinded, controlled, split-scalp study of the efficacy and safety of a 1550-nm fractional erbium-glass laser, used in combination with topical 5% minoxidil versus 5% minoxidil alone, for the treatment of androgenetic alopecia. Lasers Med. Sci. 34, 1857–1864 (2019).
32. Huang, Y., Zhuo, F. & Li, L. Enhancing hair growth in male androgenetic alopecia by a combination of fractional CO2 laser therapy and hair growth factors. Lasers Med. Sci. 32, 1711–1718 (2017).
33. Cohen, P. R. Laser-assisted drug delivery for the treatment of androgenetic alopecia: ablative laser fractional photothermolysis to enhance cutaneous topical delivery of platelet-rich plasma – with or without concurrent bimatoprost and/or minoxidil. Dermatol. Online J. 25, (2019).
34. Lukač, M., Lozar, A., Perhavec, T. & Bajd, F. Variable heat shock response model for medical laser procedures. Lasers Med. Sci. 34, 1147–1158 (2019).
35. Shanina, N. A., Patrushev, A. V & Zorman, A. Histological and Immunohistochemical Changes in Facial Skin Treated with Combined Ablative and Non‐Ablative Laser Therapy. J. Cosmet. Dermatol. (2021).
36. Dekeyser, B. Non-ablative Er:YAG-laser treatment of female patterned hair loss. PMFA J. 8, (2021).
Dr. Iva Talaber

Dr Iva Talaber, PhD, partenaire scientifique Fotona, collabore avec des médecins et des professionnels de santé sur des études cliniques concernant le laser Er:YAG pour la stimulation capillaire. Elle participe au développement du protocole HAIRestart®.